


使用校准微球技术的动脉栓塞技术(TAE)是影像引导微创治疗发展史上非常成功的篇章。自从2000年代问世以来,具有均一粒径和可预测形状的栓塞颗粒能够穿透更深,实现更末梢的栓塞。这些不同大小的新型颗粒可以被选择用于治疗从前列腺增生到肝细胞癌(HCC)等全身各种疾病。校准微球可以在一个高度选择的靶血管内机械性阻塞血液流动。目前正在尝试利用这种精确性来更准确地输送新型治疗药物,并开发生物可降解的栓塞颗粒。这种通用性使这些设备功能强大,因为其灵活的设计适用于无数的临床场景,例如提高实体肿瘤对免疫治疗的临床反应。本文综述了目前最常用的微球产品及其应用。
机械性能及局限性
微球技术的改进使经导管介入治疗的临床应用日益扩大。早期栓塞材料,包括自体血凝块、弹簧圈和明胶海绵,被证明有助于治疗急性出血。然而,当需要更末梢栓塞时,它们缺乏必要的改进。此外,由于它们不可预测的大小和形状,非靶向栓塞的风险很高。气体交换发生在末梢微血管中,这里的小动脉和毛细血管的直径为10 - 30 μm。即使采用最佳的栓塞技术,也常常导致更近端血管(直径为> 40 µm)的阻塞。鉴于近端栓塞的特性,组织灌注将通过侧枝循环和新的灌注血管持续存在。Johnson等人在兔肿瘤模型中量化了这种残余灌注。用100 - 300 μm的微球栓塞肿瘤至血流停滞,仅使56%的肿瘤微血管血流停止。栓塞至停滞和接近停滞之间的主要区别在于新的灌注微血管的出现,而这在栓塞至血流停滞的肿瘤中几乎不存在。我们最近的研究通过评估不同大小的微球 (40-60 µm vs 70-150 µm) 栓塞后肿瘤微血管的缺氧程度,证实了这些发现。较小的微球能更深地穿透入肿瘤血管,减少了侧枝残余灌注的可能性,从而导致更严重的坏死。当使用太大的微球栓塞靶血管时,残余灌注使缺氧的肿瘤细胞得以存活。因此,开发出校准的栓塞颗粒是必要的,并且其适应各种血管和内脏介入的栓塞,包括药物输送和内放射治疗。
栓塞颗粒的进展
自1970年代以来, PVA颗粒作为一种可靠且经济的栓塞剂被用于栓塞治疗并迅速得到广泛应用。PVA是可压缩的,但在导管输送后会恢复形状。早期PVA产品的粒径分布不均匀,粒径范围为100 - 1100 µm,其后这种栓塞剂被改良成较小的、校准的PVA (Contour,Boston Scientific Corporation)。
栓塞颗粒的另一个突破是三丙烯明胶微球(TAGM) (Embosphere, Merit Medical Systems)。Embospheres是带有明胶涂层的丙烯酰胺单体的聚合物。这些紧密校准的微球携带阳离子,使得它们具有亲水性和抗聚集性。通常,这些颗粒在注射前悬浮在造影剂和生理盐水中,并提供40 - 1200 µm的校准尺寸。与TAGM相比,在子宫动脉栓塞(UAE)临床前模型中,不均匀PVA颗粒的近端和远端聚集率更高。使用相应尺寸的球形PVA颗粒可获得类似的即刻技术成功率,但在术后3个月的影像中显示出明显更高的不完全缓解率。与TAGM相比,PVA的高度可压缩性可能导致颗粒的形态变化和非靶向再分布,从而导致反应率欠佳。
Bead Block(Boston Scientific Corporation)代表了PVA颗粒的另一个进步。它们是由生物相容的PVA水凝胶与丙烯酸聚合物交联组成的校准微球。Bead Block具有独特的吸湿性,水分子散布其间,导致堵管和颗粒聚集发生率较低。然而,它们的吸湿性通常需要较长的准备时间。Embozene微球(Varian Medical)是另一种高度校准的微球,由不可吸收的外覆Polyzene-F聚合物的水凝胶制成,有40 - 1300 µm等多种尺寸。
药物洗脱微球技术的发展彻底改变了经导管栓塞技术。有几种可用的设备,包括含有磺酸基团的PVA微球(DC Bead, Boston Scientific Corporation),含有丙烯酸钠基团的微球(HepaSpheres, Merit Medical Systems),以及药物洗脱版的Embozene (Oncozene, Varian Medical)。DC Beads是PVA与2-丙烯酰胺-2-甲基丙烷磺酸盐的共聚物,可以通过离子交换与低分子量且带正电荷的药物结合。类似地,HepaSpheres利用醋酸乙烯酯和丙烯酸甲酯单体的聚合作用来结合化疗药物。这些药物洗脱微球(DEBs)可以加载和释放伊立替康和多柔比星,而这些药物主要用于肝肿瘤的TACE治疗(图1)。
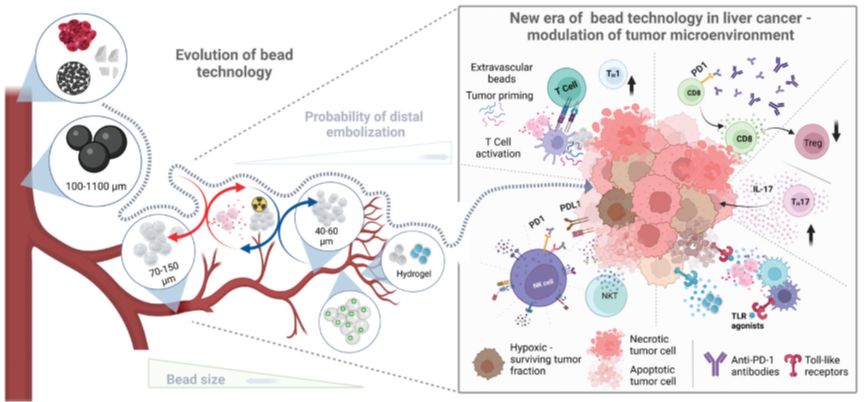
图1. 微球技术历史和发展示意图。左图:颗粒材料的改良和直径缩小,以实现更精准更末梢的栓塞。从自体血凝块、不锈钢球、明胶海绵进化为各种材料和直径的校准微球,以适应更复杂的治疗类别,并改善药物释放特性。右图:不断扩大的以导管为基础的介入治疗与免疫治疗相结合,以克服免疫抑制肿瘤微环境的挑战。顺时针方向:联合治疗中,血管外的微球激活了T细胞并激发肿瘤,增强了细胞毒性反应,激活了Toll样受体,同时免疫检查点抑制激活了自然杀伤细胞。
微球技术用于良性疾病的最新进展
校准微球技术固有的灵活性特别适合于良性疾病的栓塞,这些疾病的栓塞靶血管是特定的血管丛。最佳的子宫肌瘤栓塞技术需要栓塞直径为500-800 μm的肌瘤周围血管丛。较小的校准颗粒(< 500 μm)可越过血管丛,滞留在较细的小动脉中,这可能导致子宫肌层梗死。因此,通常首选500-700 µm或700-900 μm的不可吸收微球。成功治疗需要使用精确直径范围的栓塞颗粒,这使得FDA批准了几种用于UFE的栓塞颗粒,包括PVA和TAGM。校准微球提供了精确的栓塞水平,导致不同的栓塞终点模式。使用微球栓塞后,子宫动脉内的血流减慢足以证明栓塞剂充分穿透到肌瘤周围血管丛,而非校准的栓塞颗粒则通常以造影剂停滞作为栓塞终点。由于存在术后卵巢功能永久性降低的很小风险,人们对开发一种用于UAE的临时性栓塞剂重新产生了兴趣。Hacking等人使用新型的、700-1000 μm的生物可吸收凝胶微球连续对23名患者进行了UFE,栓塞终点为完全停滞。术后3个月MRI显示,83%的患者100%的肌瘤梗死,这一比率与使用永久性栓塞剂进行的栓塞相当。其他几种临时性栓塞微球目前正在进行各种临床前研究。
校准微球对于前列腺动脉栓塞(PAE)也具有独特的优势。UK-ROPE研究显示,较小的Embozene微球(< 400 µm) 和100-200 µm的非球形PVA的PAE术后的临床结果相似。Bilhim等人也报道了类似的结果,他们使用300-500 μm 的Bead Block和100-300 μm的非球形PVA颗粒,PAE术后2年的技术和临床成功率相当。另一项单中心随机临床试验显示,使用100-300 µm和300-500 µm Embosphere进行PAE的结果没有显著差异。小粒径组与大粒径组在轻度不良事件(如排尿困难、尿频、血尿)方面有显著差异(86% vs 41%)。两组均无严重不良事件的记录。Wang等人证实,与单独使用100 µm PVA颗粒相比,联合使用50 µm和100 µm PVA颗粒进行PAE后,临床和影像学结果得到改善。Bagla等人也报道了在PAE治疗良性前列腺增生患者时使用Embozene具有类似的有效性和安全性。进一步的前瞻性多中心研究正在进行中,以确定PAE的最佳栓塞剂。
肿瘤微环境的新概念
最新的研究对肝肿瘤栓塞后的微环境进行了更详细的描述。因肿瘤供血动脉突然闭塞而导致的缺氧损伤的程度是治疗结果的关键决定因素。当缺血和药物毒性联合仍不足以杀灭整个目标肿瘤时,存活下来但处于应激状态的癌细胞可以通过激活细胞迁移、血管生成和转移等相关的生存途径来适应缺氧和营养匮乏的环境。我们的临床前研究表明,在肝动脉栓塞(HAE)和DEB-TACE治疗后3天,存活肿瘤细胞的缺氧应激增加,7天后下降。所有治疗臂的肿瘤缺氧反应证明微球的大小对存活肿瘤细胞的缺氧应激有显著影响,我们观察到,相比于40-60 μm微球治疗组,70-150 µm微球治疗组中的大鼠有更高程度的残余肿瘤缺氧应激。
传统上,研究HAE对肝实质影响的实验主要聚焦于HCC患者的循环外周细胞。这些研究分析了TACE前、后的循环免疫细胞亚群,包括CD4+细胞(Th1、Th17和Treg细胞)、CD8+ T细胞、NK细胞和NKT细胞,以及血浆细胞因子,发现TACE后1个月循环Th17细胞的出现频率显著增加。此外,在大鼠HCC模型中,经空白TAE后,Th17细胞的全身和肝脏募集以及它们的标志性细胞因子白细胞介素-17A的表达增加,在促炎症微环境中发挥了核心作用。最近的研究着重于HCC中使用TAGM微球栓塞后的免疫反应,研究表明,治疗后肿瘤中含有明显更多的CD3、CD4和CD8肿瘤浸润淋巴细胞,而微球位于血管外对于诱发更强的免疫反应至关重要。这些发现确证了我们最近观察到的结果,即栓塞治疗后肿瘤内CD8和FOXP3 T细胞增加,以及瘤周巨噬细胞数量增加(图2)。
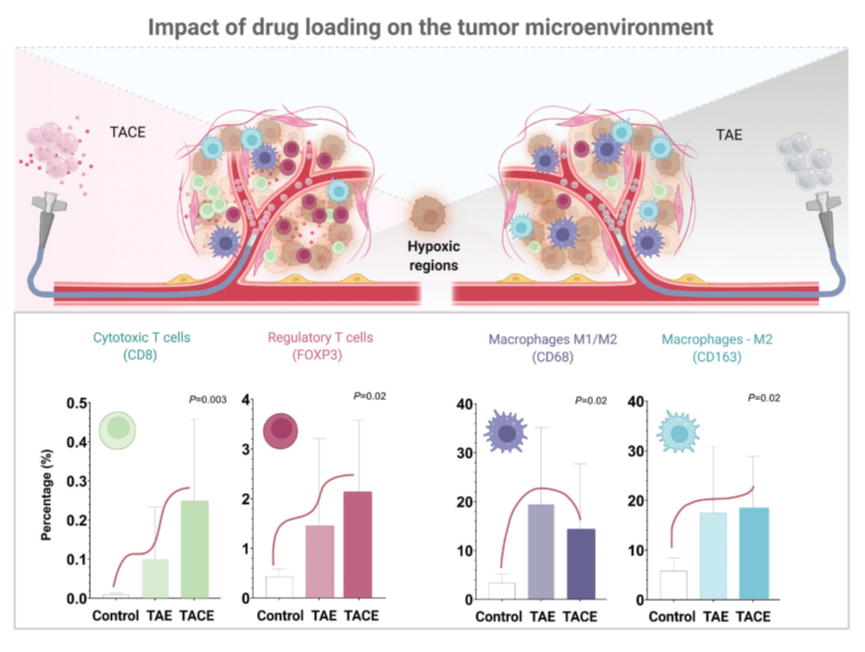
图2。使用未加载或加载盐酸多柔比星的含磺酸基团的PVA微球行TAE后肿瘤微环境的不同反应。上图:不同栓塞方式治疗后的肿瘤微环境反应示意图。下图:在多柔比星洗脱微球治疗的肿瘤中观察到细胞毒和FOXP3表达T细胞(CD8+,Tregs)有更高的浸润 (左)。与生理盐水对照组相比,观察到微球治疗组有明显的肿瘤巨噬细胞向M2状态极化的趋势。然而,在随访期间(术后14天),DEB组和空白微球组之间未观察到明显的差异趋势(右)。
肝癌的研究进展
经导管肝动脉化疗栓塞术仍然是中晚期HCC患者微创治疗的中流砥柱,也常用于治疗神经内分泌癌肿瘤和结肠癌的肝转移。对cTACE中化疗药物所引起的全身毒性的担忧导致了DEB-TACE的出现。这种方法有力结合了血管闭塞引起的缺血与药物输送。用于TAE和TACE的典型微球粒径为100 - 300 μm。丰富的肝侧支循环为彻底闭塞肝肿瘤血管带来了挑战,也使得栓塞后肿瘤内缺氧的严重程度难以预测。与血管栓塞后的缺血应激不同,DEB-TACE后多柔比星对肿瘤的影响不是即刻的,因为药物会洗脱进入周围组织。Gaba等人证实,提高微球加载多柔比星的浓度会导致兔VX2肿瘤更明显的坏死。这些结果强调,在微球附近的多柔比星会在栓塞后缺氧肿瘤微环境和免疫背景方面影响存活的应激癌细胞,这使联合应用新型免疫调节剂的策略成为可能。
免疫疗法的兴起使晚期疾病患者产生了持久的反应,从而改变了肿瘤学领域。该疗法通过重置共刺激信号和之间的平衡起效,免疫检查点可以调节肿瘤免疫微环境中细胞毒T细胞的活性和反应强度。但很多患者并没有从这些新疗法中完全受益。对免疫治疗的充分反应有几个众所周知的障碍,包括肿瘤抗原的低免疫原性、抗原耐受、浸润性细胞毒T细胞数量有限、以及免疫抑制的肿瘤微环境。
传统TAE后完全动脉阻塞造成的缺氧似乎创造了一个免疫抑制的肿瘤微环境。初始栓塞后存活的受损缺氧肿瘤细胞是治疗结果的主要决定因素,这些存活的肿瘤细胞通常表现出更强的侵袭性。另一个重要的考虑是,在最初的栓塞损伤中存活下来的细胞群可能会进入静止状态,这再次为它们提供了保护,以抵抗针对细胞周期的细胞毒性药物。DEB-TACE和免疫疗法的结合可以克服这些挑战。研究已经证实了联合应用肝脏局部治疗和免疫检查点抑制剂的安全性和耐受性。Wu等通过回顾性研究评估了仑伐替尼与抗PD-1免疫治疗联合TACE的安全性和有效性,取得了较高的肿瘤反应率(77.4%),优于既往观察到的血管内皮生长因子抑制剂与抗PD-L1抗体联合全身治疗的反应率。DEBs在输送其他免疫调节剂和激活关键的免疫刺激途径方面具有巨大的潜力,同时还降低了全身毒性。DEBs可用于输送Toll样受体激动剂,这是很有前景的一类药物,它们可能引发抗肿瘤反应,而静脉内给药与不可接受的全身毒性有关。作者已经成功地将这些新型药物加载在微球上进行局部输送,表现出良好的释放特性。
结论
为了提高栓塞效果,需要熟悉不同微球的机械性能及其对组织微环境的影响。最近的研究已经确定了微球的直径、药物加载和位置对栓塞后炎症环境的作用。对细胞水平变化的细化将使影像引导的微创介入治疗与免疫治疗相结合成为可能。
 企业邮箱Enterprise email
企业邮箱Enterprise email